史上最贵的天价药怎样了?

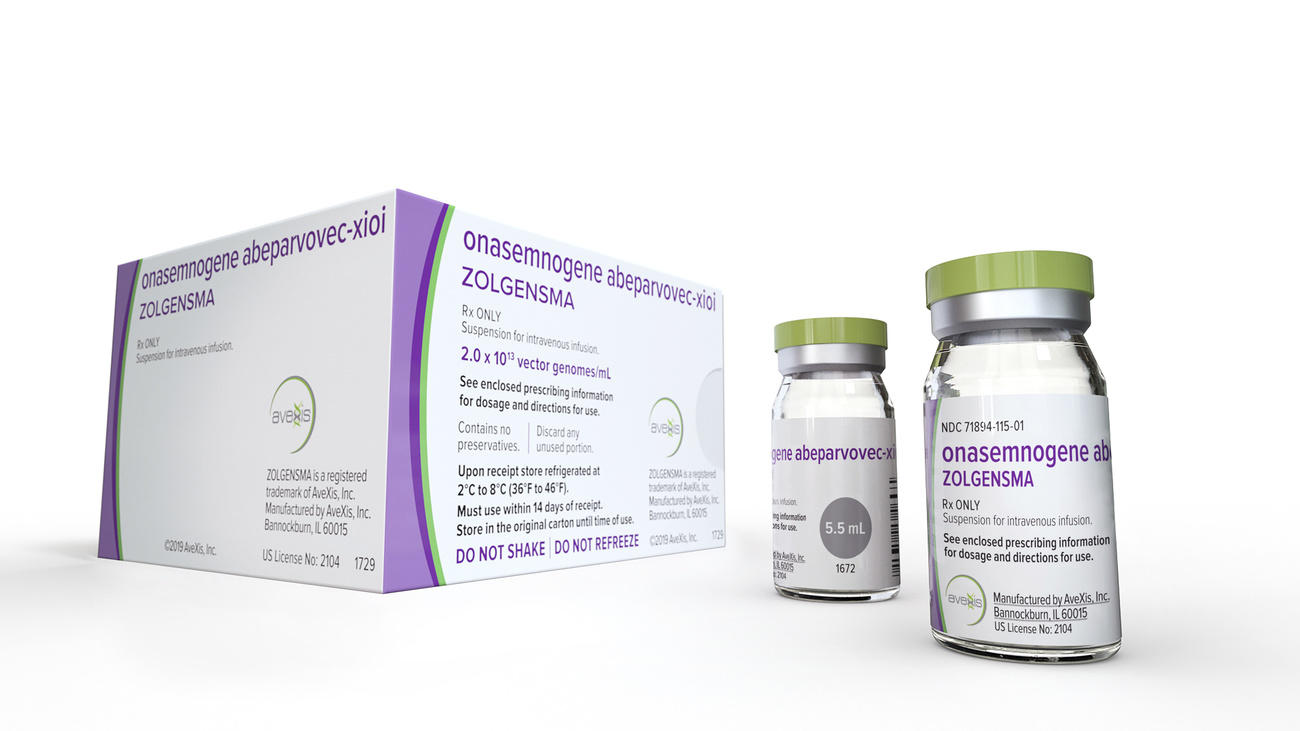
Zolgensma是一次性治疗药物,用于治疗患有罕见致命遗传病的婴儿,五年前以210万美元的天价投放市场。但由于年销售额开始下降,新市场又难以开拓,该药的瑞士生产商诺华公司(Novartis)面临着越来越大的压力。
閱讀本文繁體字版本請 點擊此處
点击这里,订阅瑞士资讯swissinfo.ch时事通讯(Newsletter),迅速、深入互动地了解瑞士第一手新闻资讯。
今年1月,诺华首席执行官万思瀚(Vas Narasimhan)在公布公司2023年度业绩时,甚至只字未提Zolgensma。2019年这款药物上市时备受瞩目,它是首个治疗脊髓性肌萎缩症(SMA)的基因药物,脊髓性肌萎缩症是一种罕见的神经肌肉疾病,也是全球婴儿死亡的重要遗传因素。
这种一次性注射药物最初被宣传为脊髓性肌萎缩症的潜在治愈方案,有望成为这家瑞士制药巨头六大增长引擎之一,具有数十亿美元的销售潜力。当时分析师的一致预期是,这款药物年销售额可达19亿美元(合人民币137.56亿元),但一家投资银行预测的年销售额却高达28亿美元。在欧洲药品管理局于2020年批准这款药物附条件上市后,其2021年销售额同比大增46%,达到13.5亿美元。
但阿哌奥诺基(商品名为Zolgensma)未能保持强劲的销售势头。按美元计算,2022年的全球销售额仅增长了1%,2023年则下降了11%,降至12.1亿美元。在其最大的单一市场美国,去年销售额下降了14%至3.72亿美元,这是连续第二年下降。
罗兰贝格咨询公司苏黎世办公室执行合伙人马蒂亚斯·邦特(Matthias Bünte)对此并不感到意外,他专注于研究制药公司的市场拓展和增长策略。邦特说:“这款药物在主要市场度过最初的增长阶段后,销售额会受到符合用药条件的脊髓性肌萎缩症患者出生率的限制。”对于一次性治疗药物而言,这是意料之中的情况。它与慢性病药物不同,后者可以通过不断增加的新患者持续创造收入。
Zolgensma销售额下降并逐渐淡出诺华财报电话会议,与公司在2018年收购该药物研发机构AveXis时的乐观预期形成了鲜明对比。诺华当时以87亿美元收购这家纳斯达克上市的初创公司,意在增强其基因治疗业务。
诺华公司的一位发言人在一份声明中向瑞士资讯swissinfo.ch表示:“销售额增长趋缓的一个重要原因是,[美国等]成熟市场现在主要治疗的是新发病例而非现有病例。”换句话说,该公司已经触及到所有符合用药条件的存量脊髓性肌萎缩症患者,今后只能依靠新确诊患者来支撑该药物在这些市场的销售增长。
诺华公司发现,要打入美国和欧洲相对富裕国家以外的市场颇具挑战,因为医疗预算紧张的各国政府质疑这种药物的疗效是否足以证明其价格的合理性。
相关内容
“史上最贵药”,何以卖出1465万元人民币的天价?
美国食品和药物管理局(FDA)被广泛认为是全球药物审批的金标准。2019年,FDA率先批准Zolgensma上市,当时诺华公司为其定价210万美元,使其成为有史以来最昂贵的一次性治疗药物。
尽管截至2024年1月,Zolgensma已在51个国家获批上市,并治疗了3’700多名患者,但只有35个国家提供商业报销,这使得许多脊髓性肌萎缩症患者无力负担这种救命药,有些人只能通过众筹来筹集治疗费。
证明价格的合理性
全球大约每1万名婴儿中就有1人患有脊髓性肌萎缩症,在美国每年约有300名婴儿患病。它由SMN1基因突变引起,这种基因突变导致细胞无法产生足够的SMN蛋白,而这种蛋白负责向肌肉发送重要信号。这种蛋白不足会损害运动神经元,导致肌肉弱化。
如果不进行治疗,患有最严重脊髓性肌萎缩症的婴儿可能永远无法抬头或抬腿,吞咽和呼吸也会很困难。这些婴儿大多在两岁前因呼吸问题而死亡。成人也可能患上脊髓性肌萎缩症,但往往症状较轻。
治疗脊髓性肌萎缩症等罕见疾病的药物通常需要数年时间和数十亿美元才能研发出来。药企将这些药物的价格定得很高,以收回投资并弥补销量的不足。
诺华公司为Zolgensma的定价辩解称,这是一种一次性注射药物,针对疾病的基因根源问题。通过将正常的基因替换有缺陷的基因,这种药物不仅能挽救生命,还能免去家庭和公共卫生系统昂贵的终生治疗费用。
在基因疗法上市之前,唯一可用于治疗脊髓性肌萎缩症的药物是美国渤健公司(Biogen)于2016年推出的诺西那生钠注射液(商品名为Spinraza),患者需接受终生治疗,每年药费在30万至50万美元。如果接受十年的治疗,这种每年进行三次脊髓注射的药物总费用将远超Zolgensma 210万美元的售价。
诺华公司没有解释Zolgensma的具体定价方式,而独立评估机构对其公允定价的测算差异巨大–从71万美元到210多万美元不等–这也导致诺华这款天价药物的定价理由面临更多争议。
当这种药物高价上市时,实际接受治疗的患者数量极少,这也引发了人们对其真正价值的质疑。与许多治疗危及生命的罕见病的药物一样,Zolgensma在美国、欧洲和日本通过加速审批上市,这让患者可以更快用上这种救命药。
美国食品和药物管理局的批准决定基于已完成的早期试验和正在进行的晚期试验,这两项试验共涉及不到40名患者。大多数注射Zolgensma的婴儿都存活了下来,能够自主呼吸,并在用药两年后达到了一些重要里程碑,比如自主坐立。
然而,治疗效果存在显著差异,部分儿童出现了严重的副反应,包括肝脏损伤。此外,由于试验时间较短,关于药物疗效持续时间的数据尚缺乏。美国以外的试验参与者也很少。
在美国及一些富裕国家,Zolgensma被限定用于患有最严重脊髓性肌萎缩症的最年幼患者(两岁以下),因为在这些国家,Zolgensma的安全性和有效性证据最为充分。
欧洲药品管理局批准该药物用于体重不超过21公斤的儿童,包括5岁及以下的幼儿,但许多欧盟成员国只报销6个月以下儿童的治疗费用。
高药价阻碍治疗
由于在成熟市场的增长潜力有限,拓展Zolgensma的地域覆盖范围对诺华来说至关重要。但是,考虑到其他医疗需求也要投入资源且整体预算有限,许多中等收入国家希望看到更多证据,证明这种药物的定价具备合理性。
薇拉·佩佩(Vera Pepe)向瑞士资讯表示:“对于罕见病,我们面临的挑战是,我们需要快速获得药物,但同时药物价格又非常高,而且存在很多不确定因素。有时我们无法确切知道药物真正的临床疗效。这会给全社会带来负担,因为给临床疗效证据有限、不确定性很大且极其昂贵的药物提供资金,机会成本巨大,尤其是在我们这样的全民医疗保障体系中。”薇拉是一名公共卫生研究员,同时也是一篇关于Zolgensma在巴西市场准入情况的论文的共同作者。
经过两年多的价格和条款谈判后,巴西政府与诺华公司最终于2022年底达成协议。诺华同意以110万美元的单次注射价格为不超过250名婴儿提供治疗,并承诺在巴西开展该药物治疗的长期效果研究。
但包括土耳其在内的其他国家仍以安全性和有效性证据不足为由拒绝使用这种药物。
全球药品定价和退款管理解决方案提供商Lyfegen的首席执行官吉里沙·费尔南多(Girisha Fernando)表示:“药企不能再仅仅向市场推出售价200万美元的药品,并指望政府为其买单。他们需要提供的不仅仅是这些。
诺华表示希望能让中等收入国家也能用上Zolgensma,并正在向保险机构和国家卫生部门提供折扣、分期付款计划和风险分担协议,让它们根据事先商定的治疗效果进行支付。
去年,诺华与阿根廷国家医疗支付机构签订了这样一份协议,以130万美元的单价提供Zolgensma。根据Lyfegen协议库中的一份合同副本,只有“根据现有科学证据,在患者身上观察到的结果符合预期”时,才会进行支付。
对于脊髓性肌萎缩症患儿的家庭来说,等待药物治疗的过程非常煎熬。患儿延迟治疗的时间越长,病情就会恶化得越厉害,而Zolgensma也无法逆转病情的进展。
数据困境
诺华公司在一定程度上得益于更多的临床试验结果,以及来自全球医疗服务提供者的所谓“真实世界数据”。这些数据显示,许多接受该疗法的患者都取得了积极的疗效。
2023年3月,诺华自行开展的研究表明,婴儿时期注射Zolgensma的患者在用药7年后仍能保持主要的运动里程碑,比如坐立,并能在无辅助的情况下呼吸。病情较轻的大龄儿童在注射较高剂量的新版Zolgensma后,病情也有所改善。
相关内容
瑞士初创公司颠覆全球医药付费模式
不过,部分患者的病情没有进一步改善,81名参与研究的儿童中有24名后续转而使用其他脊髓性肌萎缩症药物。其他研究,包括瑞士一项涉及九名患者的研究,也突显出潜在结果的巨大差异。
越来越多的试验和治疗结果表明,最初关于Zolgensma能够一次性治愈脊髓性肌萎缩症患者的炒作并没有在现实世界中得到证实。
家长们期盼自己的孩子能被治愈,因为这种基因疗法上市之初就是这样被宣传的。欧洲脊髓性肌萎缩症患者权益组织和瑞士脊髓性肌萎缩症患者权益组织的负责人妮可·古塞特(Nicole Gusset)告诉瑞士资讯:“这让人们对一种非常复杂且仍未被完全理解的疾病产生了不合理的治疗预期。治愈这个词意义重大,必须慎用。疾病进展趋于稳定或症状消失确实是巨大的成功,但这并不意味着疾病已被治愈。”妮可的女儿也患有脊髓性肌萎缩症。
随着其他治疗脊髓性肌萎缩症的药物陆续上市,诺华面临的压力也在增大。2020年,美国食品和药物管理局批准瑞士罗氏公司(Roche)的利司扑兰(商品名为Evrysdi)上市销售,用于治疗年龄较大的儿童患者以及成人患者。近期,这款药物的适用人群经批准扩大到两个月以下的婴儿,这使其成为Zolgensma更直接的竞品。
Evrysdi有药丸和糖浆两种口服剂型,比基因疗法更容易给药,年费用在10万至35万美元之间,具体取决于患者的体重。Evrysdi已在100多个国家获批上市,并已治疗全球11’000多名脊髓性肌萎缩症患者。
古塞特说:“所有这些药物都能控制疾病的进展。现阶段我们还不清楚哪种药物对哪些人群或哪些个体最有效。”
合理定价
其他投入数十亿美元研发新药的基因疗法研发机构正密切关注这家瑞士制药巨头如何应对这些不利因素。目前在美国有超过1’500项有关细胞和基因治疗的注册临床试验,去年美国食品和药物管理局共批准了五款相关新药上市,其中包括两种治疗镰状细胞病的药物,它们的定价比Zolgensma还高,分别为220万美元和310万美元。
今年3月,Orchard Therapeutics公司的基因治疗药物Lenmeldy(又称Libmeldy)在美国创下了425万美元的药价纪录,这款药物用于治疗异染性脑白质营养不良,这是一种侵袭幼儿中枢神经系统的极罕见遗传病。在美国,这种疾病每年影响大约40名新生儿。
药品定价专家、苏黎世大学法律与医学系教授科尔斯汀·诺埃勒·沃金格(Kerstin Noëlle Vokinger)指出:“政府面临着向患者提供新药的压力。这可以理解,因为罕见或致命疾病患者需要治疗。但问题是,当你不清楚一种药物的真实治疗价值时,如何与药企进行价格谈判呢?”
相关内容
编辑:Nerys Avery,编译自英文:瑞士资讯中文部/dh

符合JTI标准











您可以在这里找到读者与我们记者团队正在讨论交流的话题。
请加入我们!如果您想就本文涉及的话题展开新的讨论,或者想向我们反映您发现的事实错误,请发邮件给我们:chinese@swissinfo.ch。