Est-ce la fin de la médecine abordable?
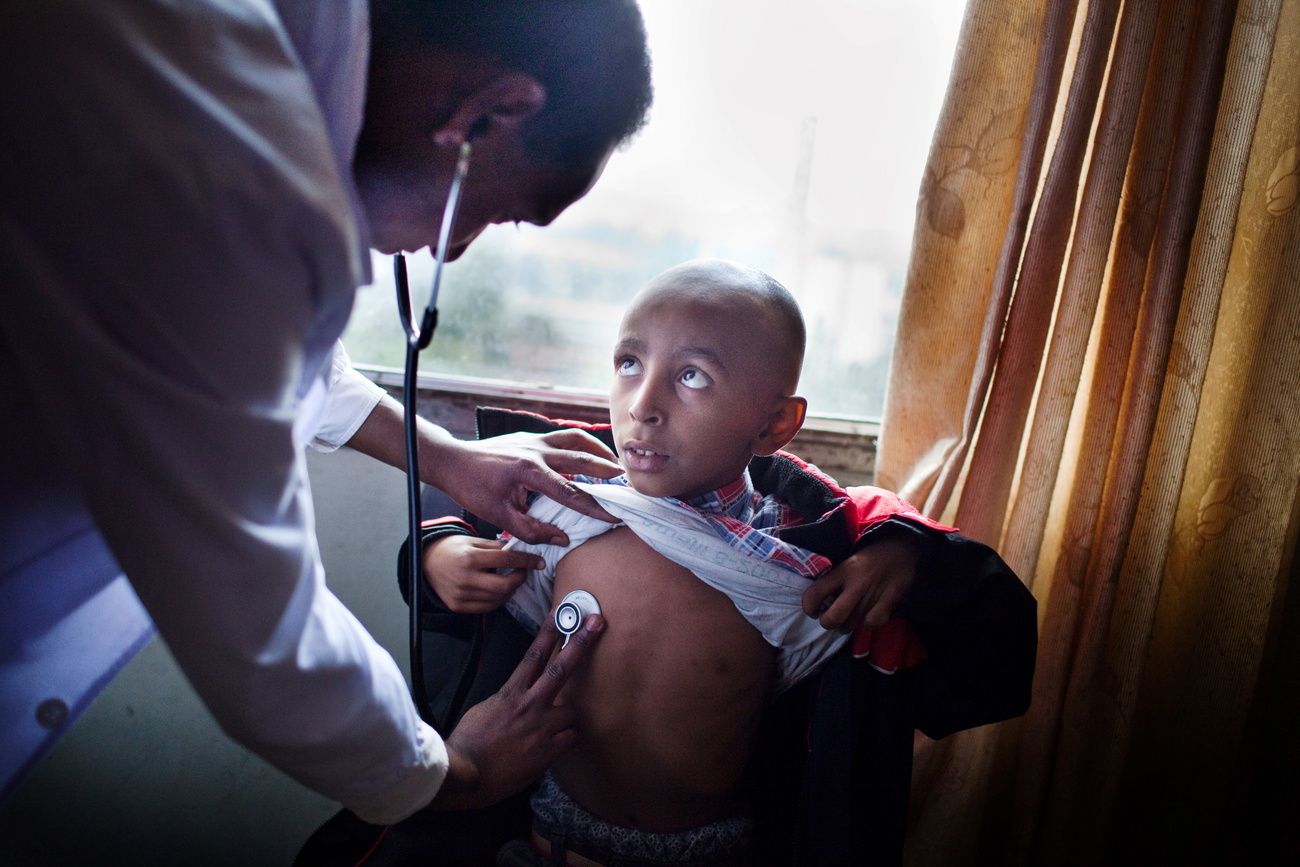
Les sociétés pharmaceutiques seront bientôt en mesure de soigner de nombreux cancers et maladies génétiques. Mais les coûts de ces traitements sont prohibitifs pour une grande partie du monde.
Il y a dix ans, une équipe de recherche en cancérologie de l’Université de Pennsylvanie, dans le nord-est des Etats-Unis, a touché au Graal.
Tout est parti là-bas d’un prélèvement de globules blancs – élément essentiel du système immunitaire – chez une fillette âgée de six ans, atteinte d’une leucémie aiguë lymphoblastique, cancer fréquent chez l’enfant. Des cellules reprogrammées pour lutter contre la maladie ont été injectées à cette fillette déjà victime de deux rechutes après une chimiothérapie. Après deux semaines dans le coma, cette dernière s’est réveillée débarrassée de son cancer.
Le traitement qui a abouti à ce quasi-miracle porte le nom de tisagenlecleucel, une immunothérapie que le groupe bâlois Novartis a contribué à développer avant de l’écouler sous le nom de marque Kymriah. Il s’agit de la première thérapie CAR-T (Chimeric antigen receptor) approuvée par les autorités réglementaires américaines en 2017, qui a ouvert une nouvelle ère dans le traitement du cancer. Mais alors que médecins et patientèle célébraient une percée majeure, les assurances maladie, elles, se préparaient aux conséquences financières. Le prix fixé par le groupe Novartis se monte à 475’000 dollars pour une seule perfusion.
De manière générale, il n’est pas rare que les médicaments contre le cancer coûtent 200’000 dollars par an voire plus. Depuis plusieurs années, le nombre de nouvelles thérapies a explosé et leurs prix aussi. Cette tendance a toutes les chances de se poursuivre, puisque les grandes multinationales de la pharma, dont Novartis, privilégient des médicaments innovants à forte valeur ajoutée, dont le potentiel de ventes se chiffre en milliards de dollars. Leur calcul étant que ces médicaments se vendront malgré leur coût élevé, grâce à leurs propriétés susceptibles de changer, voire de sauver des vies.
Mais les montants donnent le tournis aux systèmes de santé et aux malades du monde entier. A fortiori dans les pays à faible revenu, où utiliser un seul de ces médicaments peut réduire à néant l’intégralité d’un budget de santé et où le système d’assurance est déficient, contraignant les malades à payer de leur poche.
Chargé d’une clinique spécialisée en oncologie au Kenya, dans le comté de Makueni (est), le pharmacien Gavin Orangi s’interroge sur la position à adopter. «Sachant que je peux épuiser mon budget en achetant un de ces médicaments, que faire s’il peut sauver une personne mais me prive en même temps de l’achat d’autres médicaments?», résume-t-il.
Plus
L’allongement de l’espérance de vie et les changements de modes de vie ont entraîné une progressionLien externe des cas de cancer dans de nombreux pays en développement, mais les taux de survie sont nettement inférieurs à ceux des pays développés. Sur les 10 millions de décès dus au cancer enregistrés dans le monde en 2020, 70% concernaient des pays à faible ou moyen revenu. Alors qu’environ 85% des enfants atteints de cancer sont guéris en SuisseLien externe, ils ne sont que 20% en AfriqueLien externe, selon des donnéesLien externe de l’Organisation mondiale de la santé (OMS).
Les écarts pourraient encore se creuser avec les prix des médicaments, alertent déjà des spécialistes de l’équité dans le domaine de la santé. «Nous assistons à l’émergence de deux réalités parallèles», d’après l’oncologue André Ilbawi, chargé à l’OMS de la lutte contre le cancer, formé aux Etats-Unis. «D’un côté, une innovation extraordinaire qui suscite d’énormes espoirs et, de l’autre, des populations qui doivent toujours faire avec très peu, où même la gestion de la douleur en fin de vie est un problème. C’est une profonde injustice.»

Plus
Produire du biogaz au Bénin n’est pas toujours une sinécure
La révolution de l’innovation
Cette avalanche de nouveaux médicaments aux prix exorbitants résulte de percées dans la compréhension scientifique des capacités du système immunitaire à combattre les maladies, et de la composition génétique de maladies autrefois considérées comme incurables.
Dans les années 1990, des traitements tels que le trastuzumab, un médicament contre le cancer du sein écoulé sous le nom d’Herceptin par la société suisse Roche, et l’imatinib vendu par Novartis sous celui de Glivec pour mieux lutter contre la leucémie, ont considérablement amélioré le taux de survie des malades, en ciblant le gène ou la protéine provoquant la prolifération des cellules cancéreuses.
Les inhibiteurs de point de contrôle immunitaire, une forme d’immunothérapie qui débloque les capacités du système immunitaire à combattre le cancer, comptent parmi les avancées les plus récentes. Depuis 2011, une dizaine de ces inhibiteursLien externe ont été approuvés par les autorités américaines ou européennes compétentes. Mais la science est allée encore plus loin avec des thérapies cellulaires telles que le Kymriah, lequel a le pouvoir de relancer le système immunitaire via le génie génétique. Sept thérapies cellulaires de ce type ont déjà reçu le feu vert et 300 autresLien externe sont au stade des essais cliniques.
Ces progrès ont aussi permis aux scientifiques de créer des cartes génétiques des tumeurs et d’identifier quels patient-es ou groupes sont les plus susceptibles de répondre à certains traitements.
«Nous ne sommes plus très loin du moment où chaque patient-e pourra bénéficier d’un traitement unique, basé sur son profil génétique et sa réponse immunitaire», estime Olivier Michielin, chef du service d’oncologie aux Hôpitaux universitaires de Genève (HUG).
Utilisées pour les vaccins contre le Covid, les nouvelles technologies ARNm (ARN messager) ouvrent la perspective de vaccins contre le cancerLien externe personnalisés, tandis qu’émergent des thérapies géniques permettant de remplacer un gène manquant ou dysfonctionnel par un gène sain. Ces thérapies offrent l’espoir à long terme de pouvoir traiter des cancers et autres maladies héréditaires mortelles, comme la drépanocytose par exemple. Plus d’une soixantaine de nouvelles thérapies géniques sont attendues à l’horizon 2030 et deux tiers des essais cliniquesLien externe en thérapie génique ciblent le cancer.
Ces avancées ont mené à une forte progression du nombre de nouveaux traitements. Environ 215 médicaments contre le cancer ont été lancés ces vingt dernières années dans le monde, dont près de la moitié ces cinq dernières années, selon l’IQVIA, un groupe américain spécialisé dans l’analyse des données de santé.
Mais ces innovations ont un coût. Les dépenses globales pour les médicaments anticancéreux, qu’elles soient couvertes par les gouvernements, les assurances maladie ou les patient-es directement, ont augmenté l’an passé d’environ 12% dans le monde, pour atteindre la somme record de 185 milliards de dollars (environ 185 milliards de francs suisses). Ce chiffre pourrait avoisiner les 300 milliards en 2026, selon les projections de l’IQVIA dans son rapport 2022Lien externe. En Suisse, la facture moyenne annuelle pour l’oncologie a augmenté de 54% entre 2014 et 2019, pour atteindre 931 millions de francs suisses, d’après une analyse de la Radio Télévision suisseLien externe (RTS).
Si la hausse des cas de cancer et de la consommation de médicaments explique en partie cette évolution, les tarifs entrent aussi en ligne de compte. Publié en 2018, un rapport de l’OMS sur le coût des anticancéreux a révélé que le taux de croissance des dépenses dépassait largementLien externe les nouveaux cas déclarés.
On comprend mieux dès lors pourquoi les entreprises pharmaceutiques se concentrent autant sur l’oncologie aujourd’hui. De 2010 à 2019, les revenus générésLien externe par les médicaments anticancéreux ont pratiquement doublé pour les dix plus grandes sociétés pharmaceutiques dans le monde, passant de 52,8 milliards de dollars à 103,5 milliards. Dans le même temps, les revenus générés par des médicaments ne ciblant pas le cancer ont chuté de 19%.
Aux Etats-Unis, plus de la moitié des nouveaux médicaments contre le cancer approuvésLien externe entre 2009 et 2013 affichaient des prix allant au-delà de 100’000 dollars par patient pour un an de traitement. Leur prix médianLien externe est passé de 1932 dollars dans les années 1995-1999 à 14’950 dollars entre 2015 et 2019. Cette envolée pourrait être plus forte encore pour les thérapies géniques, compte tenu du fait que les premières à avoir été approuvés dépassent déjà les 2 millions de dollars pour une injection unique.
Pour justifier ces hausses, la pharma met en avant les sommes investies en amont pour la recherche et le développement de ces médicaments. Développer un nouveau médicament coûterait entre 90 millions et 2,6 milliards de dollars, avec un risque d’échec élevé devant aussi être pris en compte. Mais l’argumentaire est aujourd’hui en train de se déplacer sur la valeurLien externe que ces traitements apportent aux malades et à la société, par exemple en réduisant les coûts d’hospitalisation.
En 2019, dans une interview à l’agence de presse ReutersLien externe, le PDG de l’entreprise bâloise Novartis a résumé ainsi la position de l’industrie pharmaceutique: «Une chose que nous oublions souvent dans ce débat est l’impact remarquable de ces médicaments, qui fonctionnent avec une seule injection et ne nécessitent pas de traitement à vie. Ils sont une véritable révolution.»
Mais peu de détails filtrent sur la manière dont les prix sont fixés, les fabricants n’étant pas tenus de les divulguer. «Par principe, l’entreprise Roche ne fait pas de commentaire sur les prix», a répondu l’entreprise bâloise à SWI swissinfo.ch, ajoutant être en conformité avec l’OMS sur les exigences en matière de tarification équitable. C’est-à-dire «trouver un équilibre pour que ces médicaments soient d’un prix abordable pour les patient-es aujourd’hui, tout en incitant à investir dans la recherche et le développement expérimental (R&D), ainsi que dans l’innovation, pour les patient-es de demain».
Dans une résolution déposée en 2019, les Etats-membres de l’OMS ont toutefois fait pression pour exiger plus de transparence, sans grand progrès pour l’heure.
Cette culture du secret fâche les ONG actives dans le domaine de la santé publique. «Comment peut-on savoir si un prix est vraiment équitable en l’absence de toute transparence, d’un côté sur les sommes investies pour le développement d’un médicament et de l’autre sur les bénéfices réalisés par les entreprises?», s’insurge Patrick Durisch, responsable de la section «politique de la santé» auprès de l’ONG suisse Public Eye, engagée pour la responsabilité des entreprises. Selon l’organisation, les marges bénéficiaires de certains anticancéreux brevetés oscilleraient entre 40 et 90%Lien externe.
Les enjeux
La «valeur» de ces médicaments innovants et très coûteux devient une question pressante pour les gouvernements et les assureurs, qui doivent décider s’il est opportun de les prendre en charge financièrement et, le cas échéant, à quelle hauteur. Certains médicaments sont lancés si rapidement sur le marché que les preuves cliniques de leurs bénéfices en termes de survie et de qualité de vie font défaut.
Les gouvernements commencent à résister. En 2019, la Norvège a rejeté la commercialisation de 22% des nouveaux médicaments et traitements, la plupart contre le cancer, car elle les jugeait trop chers. L’Union européenne et le Japon, dans le sillage de la Grande-Bretagne, ont également commencé à mener leurs propres évaluations coût-efficacité des nouveaux médicaments, ce qui a conduit certaines entreprises à réduire leurs prix.
Face à cette résistance, certaines firmes proposent de nouveaux modèles de paiement plus échelonnés. C’est le cas en Italie, où Novartis a accepté un paiement du Kymriah en trois versements et seulement si les résultats se révèlent probants.
Mais des pays à plus faible revenu ont, eux, peu de leviers de négociation. Les pays dont le revenu annuel par habitant est inférieur à 30’000 dollars ne représentent que 14% des dépenses mondiales en oncologie, alors que 74% de celles-ci proviennent de seulement sept pays, dont les Etats-Unis, le Royaume-Uni, quatre pays européens et le Japon.

Quand les pays riches négocient des accords pour le Kymriah, un pays comme le Kenya se bat pour couvrir les factures des malades traités avec le trastuzumab, un traitement sur le marché depuis vingt ans.
«Nous pouvons certes obtenir certaines immunothérapies, explique le médecin Naftali Busakhala, qui a contribué à mettre en place le programme de lutte contre le cancer de l’hôpital Moi à Eldoret, au Kenya. Le problème reste le coût. Les gens ici ne peuvent pas se le permettre.»
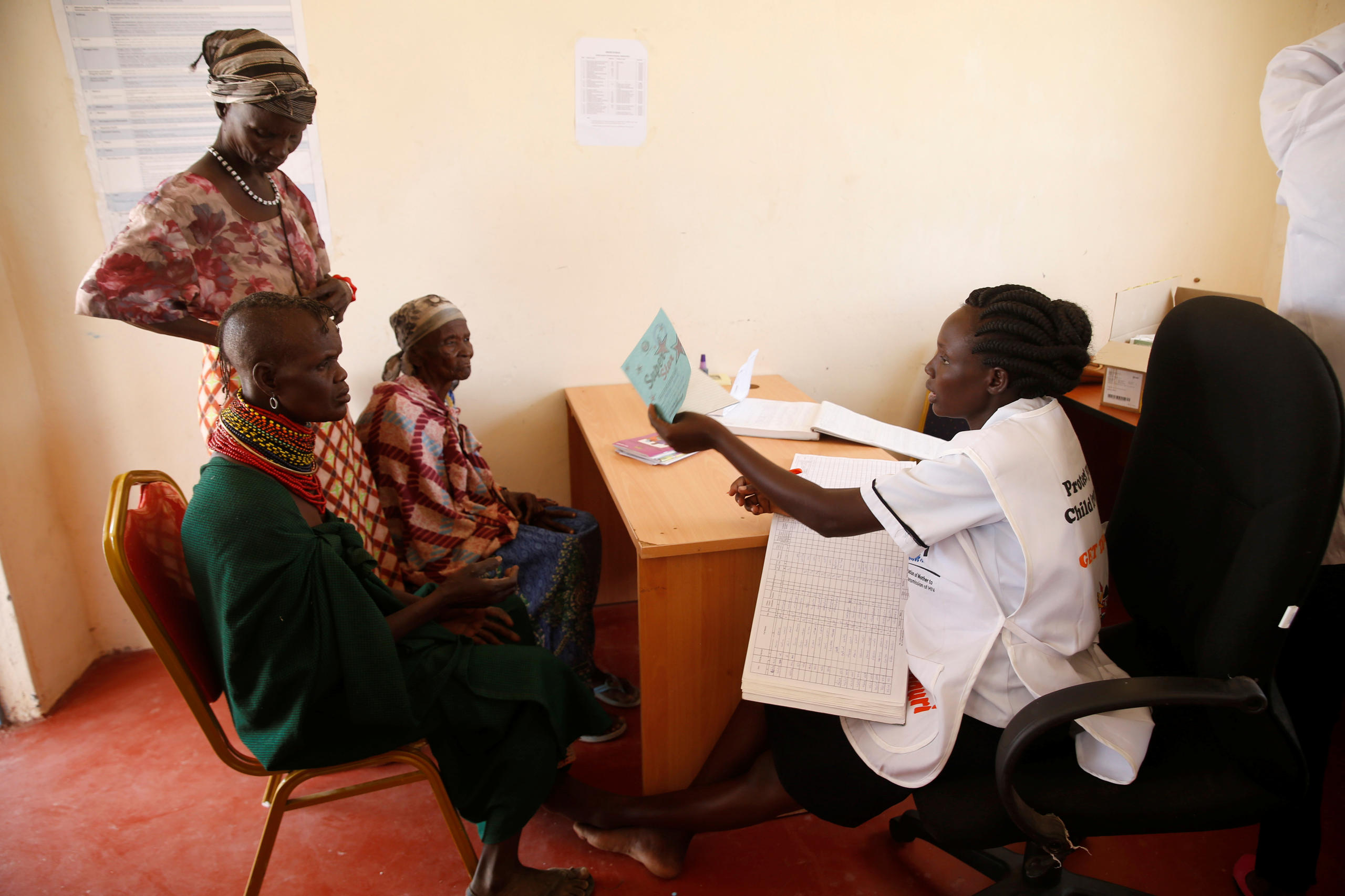
Plus
Novartis peut-il rendre ses médicaments accessibles à tout le monde?
De plus en plus d’entreprises pharmaceutiques se tournent toutefois vers les marchés émergents. Plusieurs, dont les géants bâlois Roche et Novartis, se sont notamment engagées à rendre leurs traitements les plus innovants et les plus coûteux accessibles dans les pays à faibles et moyens revenus. «Fondamentalement, les innovations n’ont pas d’importance si les patient-es ne peuvent pas y avoir accès», résume Jackie Wambua, qui dirige les affaires gouvernementales au bureau de Roche en Afrique de l’Est.
Confrontés à la hausse des cas de cancer, les pays en développement veulent eux aussi les médicaments les plus avancés. «Nous devons rendre ces médicaments plus abordables pour commencer à voir survivre des malades du cancer», souligne Mary Nyangasi, responsable du programme de lutte contre le cancer au ministère kenyan de la santé.
Collaboration reportage: Mercy Murugi. Iconographie: Helen James. Édition: Nerys Avery.
Pourquoi nous avons choisi de traiter ce sujet
Le traitement du cancer et d’autres maladies génétiques a fait l’objet d’incroyables innovations qui améliorent la survie et la qualité de vie de nombreuses personnes. Cependant, la plupart des pays du monde n’en bénéficient pas. Nous avons voulu comprendre pourquoi et ce qui est fait pour que tout le monde ait accès à des traitements qui peuvent sauver des vies.
Comment nous avons trouvé nos sources
Nous veillons à ce que tous nos articles soient équilibrés. Cela signifie que tous les faits et positions pertinents sont pris en compte lors de la sélection des sources pour analyser un sujet. Dans ce cas, nous avons contacté des organisations mondiales de santé ayant des projets au Kenya pour obtenir des suggestions de spécialistes, nous nous sommes entretenus avec les plus grandes entreprises pharmaceutiques à Bâle et au Kenya, et nous avons travaillé avec un journaliste local pour identifier les responsables gouvernementaux, les hôpitaux et les associations de malades qui influencent le débat et créent un espace où les patient-es peuvent partager leurs expériences. Nous nous sommes rendus au Kenya pour obtenir des témoignages de première main sur le sujet, et pour faire nos propres observations sur les problèmes.
Alain Meyer

En conformité avec les normes du JTI
Plus: SWI swissinfo.ch certifiée par la Journalism Trust Initiative












Vous pouvez trouver un aperçu des conversations en cours avec nos journalistes ici. Rejoignez-nous !
Si vous souhaitez entamer une conversation sur un sujet abordé dans cet article ou si vous voulez signaler des erreurs factuelles, envoyez-nous un courriel à french@swissinfo.ch.