Médicament de Roche sous surveillance aux USA
Le gouvernement américain prend des mesures exceptionnelles pour contrôler l'usage d'un médicament aux effets secondaires potentiellement mortels.
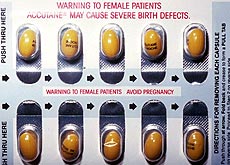
Accutane, prescrit pour les formes graves de l’acné, est accusé d’avoir provoqué des malformations chez des nouveau-nés et des suicides chez certains patients. Roche refuse de commenter.
A risques exceptionnels, mesures exceptionnelles. La Food and Drug Administration (FDA), l’instance américaine de règlementation du secteur pharmaceutique, annonce qu’elle va imposer des mesures très strictes visant à contrôler l’usage d’Accutane.
Ce médicament de Roche contre l’acné est accusé de provoquer des malformations chez les nouveau-nés et des dépressions graves avec suicides chez certains patients.
A partir du 22 août et d’ici le 31 décembre, tous les patients prenant Accutane, hommes et femmes, devront s’inscrire sur une liste nationale, de même que les médecins et pharmaciens prescrivant et vendant le médicament de Roche.
Tous les patients devront aussi, avant de commencer leur traitement, signer une décharge indiquant qu’ils ont été informés des risques potentiels d’Accutane.
Les femmes devront remplir d’autres conditions particulières, étant donné le risque de malformations. Toutes les femmes s’apprêtant à prendre Accutane devront ainsi présenter un test négatif de grossesse et s’engager à utiliser deux moyens de contraception pendant la durée du traitement. Elles auront aussi à présenter un test négatif de grossesse avant chaque renouvellement de l’ordonnance.
Une polémique au niveau national
Cela fait 23 ans qu’Accutane a été approuvé par la FDA, et presque autant de temps que la sûreté du produit de Roche soulève les soupçons. Depuis 1982, la FDA a ainsi recensé des malformations chez plus de 160 bébés mis au monde par des femmes qui prenaient ou avaient pris Accutane. Par ailleurs, la FDA a recensé au moins 200 suicides de patients.
Longtemps confinée aux journaux spécialisés et à quelques mouvements de consommateurs, la polémique entourant Accutane aux Etats-Unis est apparue sous les projecteurs le 18 novembre dernier, quand, entendu lors d’audiences au Sénat sur la FDA, le médecin-conseil de l’agence, David Graham, estima qu’Accutane devrait être retiré du marché en raison des risques qu’il pose aux patients.
Aujourd’hui, la FDA ne va pas aussi loin que son médecin-conseil le voulait, mais elle établit un système spécifique de surveillance obligatoire, alors que les mesures qu’elle avait adoptées précédemment pour tenter de contrôler l’usage d’Accutane étaient simplement recommandées, et non pas imposées.
Roche renvoie au communiqué
Contacté par swissinfo, Terry Hurley, le directeur des relations publiques de la filiale américaine du groupe suisse, refuse de répondre à toute question et s’en tient au communiqué officiel du groupe.
Dans ce communiqué, Roche se dit « satisfaite » de ce qu’elle appelle « le programme renforcé de gestion des risques » adopté par la FDA.. Roche ajoute qu’elle « travaille depuis 23 ans avec la FDA sur l’évolution des programmes de gestion des risques pour Accutane » et qualifie même cette collaboration d’« exemplaire ».
Mauvais exemple, semble répondre le député américain Bart Stupak. Démocrate représentant l’Etat du Michigan à la Chambre des Représentants, ce député a la particularité d’avoir été frappé de plein fouet par les risques d’Accutane.
Le 14 mai 2000, son fils de 17 ans, BJ, qui prenait Accutane depuis plusieurs mois, s’est tué d’un coup d’arme à feu. Pour Bart Stupak, les nouvelles mesures de la FDA sont insuffisantes.
« Ces mesures passent à côté de la moitié des problèmes associés a la prise d’Accutane puisqu’elles ne mentionnent pas du tout les effets secondaires psychiatriques, et je m’attends donc à voir de nouveaux cas de malformations et de suicides », déclare Bart Stupak à swissinfo.
Demande de retrait du marché
Le député souligne que les nouvelles mesures de contrôle de la FDA ont été mises au point avec Roche et s’étonne que l’instance de règlementation n’ait pas imposé de limites en matière de dosage.
Le député américain exige qu’Accutane soit « retiré du marché jusqu’à ce que les problèmes relatifs au cerveau et au dosage soient résolus ». « Je souhaite que la FDA retire du marché ce médicament parce que ses risques dépassent de loin ses avantages et parce que de meilleurs médicaments pour l’acné sont désormais disponibles », poursuit Bart Stupak qui accuse la FDA de « ne pas agir dans le meilleur intérêt du peuple américain » et Roche de « placer les profits avant la protection du public ».
Accutane est sensée être prescrit uniquement dans les cas d’acné les plus prononcés, mais le médicament est très souvent donné à des patients qui n’ont qu’une acné légère. Selon la FDA, 100.000 ordonnances d’Accutane et de ses versions génériques sont délivrées chaque mois aux Etats-Unis.
swissinfo, Marie-Christine Bonzom, Washington
Dès le 22 août et d’ici le 31 décembre, tous les patients prenant Accutane devront s’inscrire sur une liste nationale.
Il en va de même pour les médecins et pharmaciens prescrivant et vendant ce médicament.
La FDA a approuvé Accutane il y a 23 ans.
Depuis 1982, la FDA a recensé des malformations chez plus de 160 bébés mis au monde par des femmes qui prenaient ou avaient pris Accutane.
La FDA a recensé au moins 200 suicides de patients.

En conformité avec les normes du JTI
Plus: SWI swissinfo.ch certifiée par la Journalism Trust Initiative











Vous pouvez trouver un aperçu des conversations en cours avec nos journalistes ici. Rejoignez-nous !
Si vous souhaitez entamer une conversation sur un sujet abordé dans cet article ou si vous voulez signaler des erreurs factuelles, envoyez-nous un courriel à french@swissinfo.ch.