Brustimplantate-Skandal erreicht die Schweiz
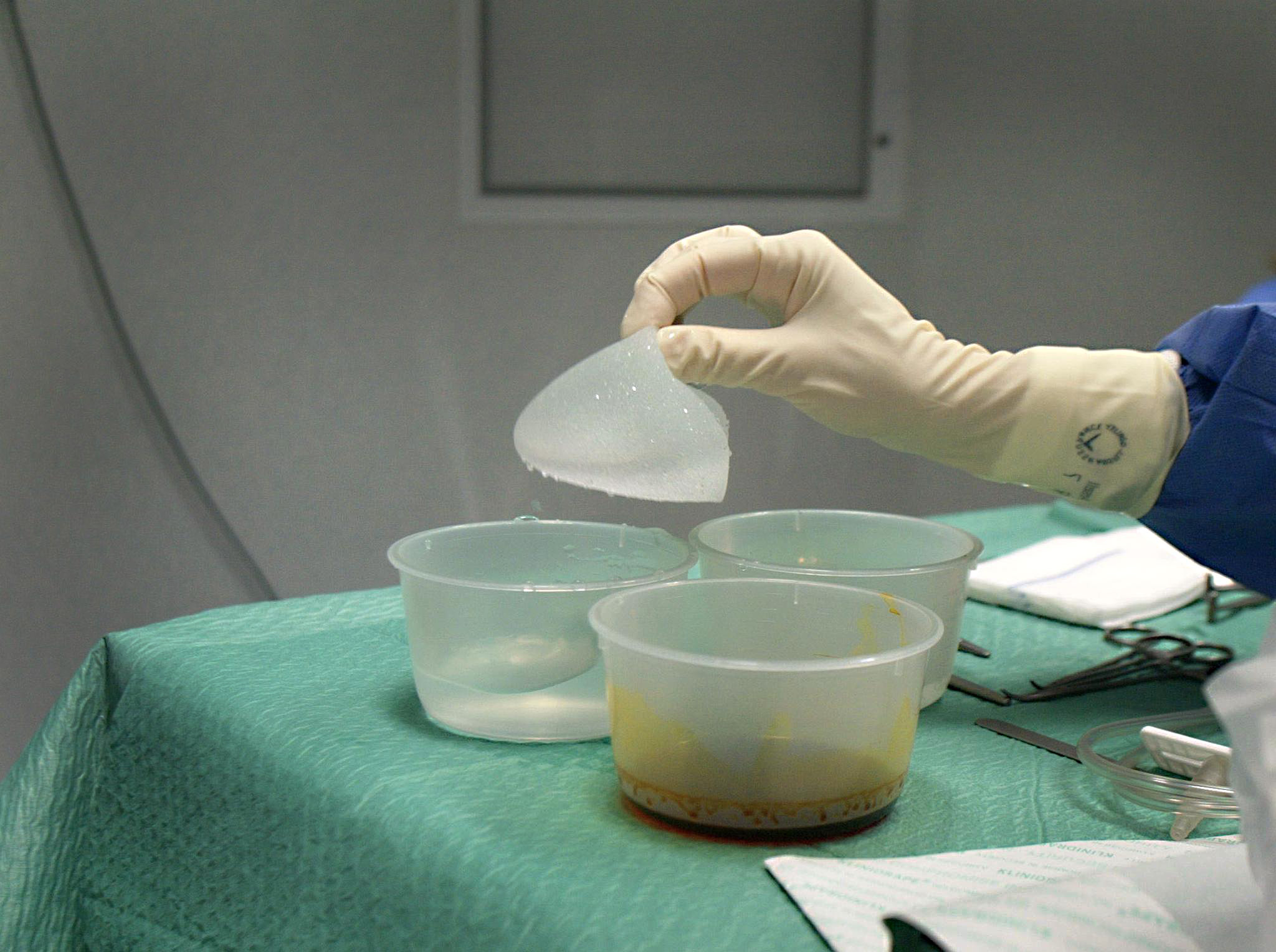
Frankreich rät Frauen mit Brustimplantaten der Firma PIP, diese zu entfernen. In Genf haben Betroffene eine Klage gegen den Hersteller eingereicht, der 2010 in Konkurs ging. Die Schweizer Behörden sind zurückhaltend und warten Entscheide der EU ab.
Swissmedic, die Schweizerische Zulassungs- und Aufsichtsbehörde für Heilmittel, hat bisher keine Empfehlung herausgegeben, wonach sich betroffene Frauen in der Schweiz Implantate von Poly Implant Prothese (PIP) operativ ersetzen lassen sollten. Auch die britischen Behörden nehmen bisher diese Haltung ein.
In Frankreich dagegen rufen die Gesundheitsbehörden die Betroffenen just zu diesem Schritt auf, nachdem Hüllen der Silikonkissen gerissen waren. Dies nachdem festgestellt worden war, dass das seit 2010 konkursite französische Unternehmen für die Brustvergrösserungen und –prothesen Industrie-Silikon verwendet hatte. Dieses hatte der Hersteller nicht auf die Verwendung als Implantate prüfen lassen.
In der Schweiz sind die Frauen, die 95c angehören, über die Risiken derart beunruhigt, dass sie bei der Genfer Staatsanwaltschaft Klage gegen PIP eingereicht haben. Der Name 95c steht für eine Brustgrösse.
Gegenstand der Klage ist der Verkauf von schadhaften Brustimplantaten in der Schweiz. Dadurch sei die Gesundheit der Trägerinnen gefährdet.
Weltweit sind 300’000 Frauen betroffen, ein Zehntel allein in Frankreich. Auch die Behörden Deutschlands, Tschechiens, der Niederlande und Venezuelas raten Betroffenen zur präventiven Entfernung.
Wut
«Die Haltung von Swissmedic, dass es sich nicht um ein sehr ernstes Problem handle und nur wenige betreffe, machte jene Frauen sehr wütend, die ein echtes Problem haben», sagt die Genfer Politikerin Salika Wenger, welche 95c gründete. Sie kennt einen Fall, in dem Implantate gerissen und Silikon in den Körper der Frau gelangt sei.
«95c umfasst nur einige Dutzend Frauen. Aber seit es uns gibt, haben wir viele Anrufe und Mails von Betroffenen erhalten, die ebenfalls Mitglied werden wollen», sagt Wenger gegenüber swissinfo.ch.
«Swissmedic hat die Aufgaben nicht gemacht, denn es ist der Job der Behörde, abzuklären, ob ein Produkt zugelassen werden kann oder nicht.» Die Behörden generell, aber insbesondere die Regierung, nähmen ihre Verantwortung nicht genügend wahr, so Wenger.
Hauptsächliche Aufgabe von Swissmedic ist die Kontrolle darüber, ob ein neues Medikament für den Schweizer Markt freigegeben werden kann. Medizinische Bestandteile aber, zu denen Brustimplantate zählen, fallen unter bilaterale Regelungen mit der EU.
So wurden die PIP-Implantate von einer Kontrollbehörde mit Sitz in Deutschland freigegeben. Dafür bürgt das Gütesiegel «CE mark», das besagt, dass das Produkt den Gesetzen der Europäischen Kommission über Gesundheit und Sicherheit entspricht.
Produkte mit dem Zeichen «CE mark» können in der ganzen EU ohne weitere Prüfungen gehandelt werden. «Swissmedic kontrolliert solche Produkte kein zweites Mal. Hat die europäische Kontrollbehörde grünes Licht gegeben, können Ärzte das Produkt kaufen und verschreiben oder verwenden», sagt Sprecher Daniel Lüthi.
Erweisen sich Produkte als schadhaft, informiert Swissmedic betroffene Patienten über allfällige Probleme. Dies sei auch im Fall PIP geschehen, so Lüthi.
EU reagiert
Das aktuelle System übertrage den Ärzten grosse Verantwortung, betont Lüthi. «Sie müssen wissen, was sie einsetzen und was sie entfernen». Diese Haltung dürfte sich aber durch den Skandal um die schadhaften Brustimplantate ändern. «Ich sehe dringenden Bedarf, die gesetzlichen Bestimmungen für medizinische Produkte denjenigen für Medikamente anzupassen», sagte Guido Rasi, der neuer Chef der europäischen Arzneimittelbehörde (EMA).
Tatsächlich hat die EU-Kommission strengere Bestimmungen zur Regulierung medizinischer Produkte angekündigt. Dazu gehören höhere Hürden für vorgängige Versuchsreihen und eine genauere Überwachung des Marktes. Die EU-Gesundheitsminister sollen noch in diesem Jahr darüber beraten. Erteilen sie grünes Licht, werde die Schweiz die strengeren Bestimmungen übernehmen, sagt Daniel Lüthi von Swissmedic.
Die französische Firma PIP (Poly Implant Prothese) produzierte Brustimplantate, die aus minderwertigem (Industrie-)Silikon bestanden.
2010 wurde PIP veranlasst, die Implantate vom Markt zu nehmen.
Zuletzt hatte die Jahresproduktion rund 100’000 Implantate betragen, von denen knapp 85% in 65 Länder exportiert worden waren. Der Hauptteil ging nach Europa und Lateinamerika.
Firmengründer Jean-Claude Mas gab gegenüber der Polizei zu, dass mindestens 75% der Implantate aus dem minderwertigen Material bestand.
Gemäss den französischen Behörden wiesen 5 von 100 PIP-Implantaten Risse auf. Bei anderen Herstellern beträgt die Rate 1%.
Bei Rissen kann Silikon in den Körper gelangen. In Frankreich wurde bei neun Frauen Krebs nachgewiesen, deren Implantate gerissen waren. Ein Zusammenhang ist jedoch zur Zeit nicht nachgewiesen.
(Übertragung aus dem Englischen: Renat Kuenzi)

In Übereinstimmung mit den JTI-Standards













Einen Überblick über die laufenden Debatten mit unseren Journalisten finden Sie hier. Machen Sie mit!
Wenn Sie eine Debatte über ein in diesem Artikel angesprochenes Thema beginnen oder sachliche Fehler melden möchten, senden Sie uns bitte eine E-Mail an german@swissinfo.ch