
AI創薬に大きく舵を切る製薬業界

人工知能(AI)が医薬品開発における存在感を急速に高めている。スイスの製薬大手のロシュやノバルティスも巨額を投じ、AIによる新薬開発の高速・低コスト化に大きな期待を寄せる。臨床試験に進む薬の候補も出てきているが、患者に届くまでの道のりは長い。
スイス・米国・カナダに拠点を置くバイオテック企業「エンドジェナ・セラピューティックス(Endogena Therapeutics、以下エンドジェナ)」は現在、網膜色素変性症(網膜が変性する目の遺伝性の難病)の治療薬候補EA-2353の臨床試験(ヒトを対象とした有効性・安全性試験)を進めている。EA-2353は低分子化合物であり、幹細胞(分化・自己複製により他の細胞になれる未分化の細胞)を活性化し組織の再生を促す、細胞や遺伝子を使わない新しいタイプの再生医療の薬だ。
※SWI swissinfo.chでは配信した記事を定期的にメールでお届けするニュースレターを発行しています。政治・経済・文化などの分野別や「今週のトップ記事」のまとめなど、ご関心に応じてご登録いただけます。登録(無料)はこちらから。
この薬の発見は紙とペンから始まった。そう語るのは、 同社の創立者であり、EA-2353の開発者の1人でもあるマティアス・シュテーガー最高経営責任者(CEO)だ。大学で有機化学と医薬化学を学び、ロシュなどの製薬関連企業に勤務した後、エンドジェナを立ち上げた。
網膜色素変性症の薬の開発は、幹細胞や前駆細胞(幹細胞から最終的な細胞になる前の分化の過程の細胞)に影響を与えると報告された分子の構造を1つずつノートに書き留める作業から始まった。シュテーガー氏は10年近くこの作業を続けた。
薬を開発するためにはまず、列挙した分子の特徴的なパターンを見つけ出さなければならない。その特徴を骨子として複数の候補構造を提案していく。だがこの作業は熟練の研究者であっても簡単ではなく、長い年月とコストが掛かる上、うまくいくかどうかは運によるところが大きい。医薬品開発の現場で10年近く経験を積んだシュテーガー氏にとっても同様だった。
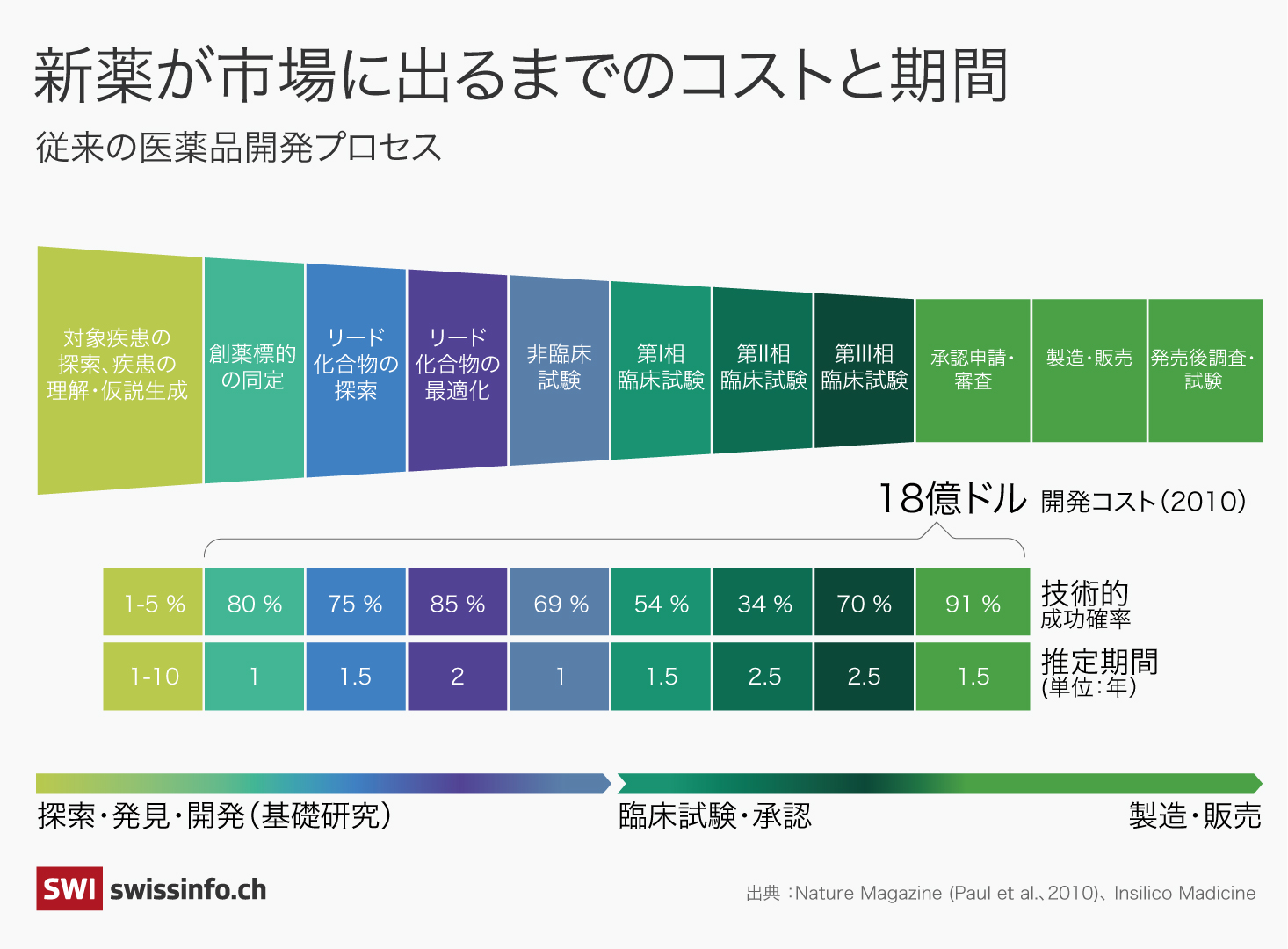
「新しい分子の発見は、広大な砂漠で1粒のダイヤを探すようなものだ。熟練の化学者であっても運と勘に大きく頼っている」とシュテーガー氏は説明する。1つの新薬が市場に出るまでには、平均で約10年の期間と約25億ドル(約3925億円)ものコストが必要だ。
そこでシュテーガー氏は、スイス連邦工科大学チューリヒ校(ETHZ)のギスベルト・シュナイダー教授にこの分子構造データを送り、効率的に分子の特徴を見つけられないか相談した。シュナイダー氏の専門はコンピューター支援による薬の分子設計であり、シュテーガー氏とは以前、ロシュで同僚だった。
シュナイダー氏は、人工知能(AI)モデルで分子の特徴的な構造パターンを見つけ、目的の生物活性を持つ可能性が高い複数の候補構造を提案した。シュテーガー氏のグループは、数年間かけてこれらの分子の合成と活性テストを行ない、 最終的に2つの新薬候補に絞り込んだ。その1つが冒頭に登場したEA-2353だ。現時点で臨床試験の初期フェーズまで進んでいる。
「AIがなければ、新薬候補を見つけられなかったかもしれない。アルゴリズムは人の目では気づかないパターンを見つけられる」とシュテーガー氏は言う。この2つの新薬候補を次のステップに進めるために、チューリヒと米サンフランシスコを拠点として、2016年にシュナイダー氏と共に立ち上げたスタートアップがエンドジェナだった。
AI技術は医薬品開発の時間とコストを大幅に削減できる可能性があることから、創薬分野でのAI投資ブームが起きている。米ボストン・コンサルティング・グループが昨年発表した調査結果外部リンクによれば、過去10年間で、AIを医薬品開発の主要技術とする「AIファースト」のバイオテック企業やスタートアップ(約200社)への投資額は180億ドルを超えた。
こうしたAIファーストのバイオテック企業やスタートアップの中からエンドジェナのように臨床試験に進む薬を開発する企業が出てきている一方、スイスのロシュやノバルティスなど製薬大手の動きも活発化している。
ロシュは2019年以降、少なくとも8件のAI関連グループとの提携を発表している。その1つは昨年発表された米半導体大手のエヌビディアとの提携であり、医薬品開発の高速化を目指した長期的な共同研究を実施する。ノバルティスは今年1月、米グーグル傘下の英ディープマインドのAI創薬スピンオフ、英アイソモルフィックラボと低分子薬の共同開発を開始すると発表した。ノバルティスは、先行投資として3750万ドル、更に、3種の新薬候補の開発に一定の成果が得られた場合には最大12億ドルを支払う。これらは過去10年間に製薬企業とAI創薬スタートアップとの間で交わされた100件を超える提携のごく一部に過ぎない。
AIの波に飛び乗る
医薬品開発におけるコンピューター活用の歴史は古く、製薬企業の多くも何十年も前から取り入れてきた。だがAI技術に依存し過ぎることには抵抗する向きがあった。
「(1990年代頃から)人工ニューラルネットワークの創薬への応用が試みられてきたが、2000年代初期の製薬企業では、AIは期待したような結果を出さないという認識が持たれていた」とシュナイダー氏は言う。当時外部リンクのニューラルネットワークなどのAIアルゴリズムはまだ現在のものほど洗練されておらず、データも十分ではなかった上、コンピューター能力も大量データの処理には不十分だった。
だが今やその認識は大きく変わった。「現在では、AIアルゴリズムから提示される結果を積極的に受け入れようという意識が以前よりもずっと高まっている。どの製薬企業も、この流れに乗り遅れたくないと躍起になっている」とシュナイダー氏は話す。
米ボストン・コンサルティング・グループは、人工知能(AI)を、データを解析・学習し、洞察を得たり、タスクを実行したりする先端的な計算・モデリング技術と定義している。多くの場合、入力されるデータは大規模かつ複雑であり、出力には人間と同等の知的レベルと、人間の能力を超える規模と速さが要求される。創薬研究では、人工ニューラルネットワークを利用してデータから知識を獲得する深層学習の手法がよく利用されている。
出典:Boston Consulting Group
この変化の背景には、近年の①ChatGPTなどの生成AIや深層学習などのAI技術の進歩②計算機の性能の向上③遺伝学や分子生物学などの関連科学分野の発展がある。
人間は約37兆個の細胞で構成され、タンパク質の合成に関わるものだけでも2万個以上の遺伝子を持つ。薬の可能性は低分子だけでも1060種類はあるとされる。医薬品の開発では、こうした多様で複雑な対象について、病気の仕組み、薬の吸収・働き・代謝、副作用や毒性などを明らかにしなければならない。そこで、画像データを含む様々な種類の大規模なデータセットの解析と特徴パターン抽出が可能な最新AIアルゴリムが大いに役立つ。
英ディープマインドは2020年、AIアルゴリズムでタンパク質のアミノ酸配列から立体構造を予測するソフトウェア「アルファフォールド(AlphaFold)」を発表した。今年5月に発表された最新版ではリボ核酸(RNA)やデオキシリボ核酸(DNA)などにも対象を広げた。アルファフォールドは、新型コロナウイルス(SARS-CoV-2ウイルス)の一部のタンパク質の立体構造の決定にも利用され、ウイルスの理解と迅速なワクチン開発に一役買った。
アルファフォールドの快挙は、分子生物学などの創薬関連分野にインパクトを与えただけでなく、AIが広く科学に変革をもたらす可能性があることを印象付けた。製薬企業は現在、商用・自社開発・オープンソースの多くのAIソフトウェアを利用し、医学雑誌からの関連データの収集、化合物ライブラリーからの有望な薬物候補の選出、創薬標的(病気の治療につながるタンパク質など、薬が実際に働く対象)の特定などを行なっている。AIの利用によって、医薬品開発の時間とコストを25〜50%削減できるとする調査報告外部リンクもある。
バーゼルのロシュで研究開発用の計算科学製品を統括するエリフ・オズキリムリ氏は「機械学習や大規模言語モデルのようなAIは、全くの新技術というわけではない。だがこの2年間でその導入と規模は急速に拡大している」と説明する。
ロシュが昨年11月に行った投資家向けの説明外部リンクによれば、同社は社内のデジタルインフラを抜本的に改革し、研究開発プロセスの一部にAI技術をより強力に組み込むために、年間約30億ドルを投じている。数年前には米マサチューセッツ工科大学(MIT)と英ケンブリッジ大学から優秀な計算生物学分野の研究者を採用し、大規模な計算科学部門を作った。米サンフランシスコにある子会社ジェネンテック(Genentech)だけで400人、加えてバーゼルやその他のロシュの拠点でも数百人が働いている。
また、ロシュは2021年に米ニューヨークの従業員3人のスタートアップ、プレシエント・デザイン(Prescient Design)を買収。公開・自社所有の実験・臨床試験データを使ったAIモデルを開発した。同社は既にこのAIモデルを利用し、既存薬再開発(既存の薬を別の疾患の新治療薬として開発すること)における疾患の探索や、薬物候補の成功可能性による順位付けを行っている。
創薬の生成AI
AI技術は医薬品開発を効率化するだけでなく、化学者が思ってもいなかった分子構造を提案できる可能性すら持っている。従来は、薬の可能性のある分子構造から生物活性や性質を予測して薬物候補を絞り込む方法が主流だったが、近年は、望みの生物活性や性質から有望な分子構造を生成する、逆解析または逆設計と呼ばれる方法も出てきた。いわば創薬分野の生成AIシステムだ。シュナイダー氏がシュテーガー氏のデータに利用したAIモデルもこのタイプだ。
「生成AIの創薬プロセスは、 1分子ずつふるい分けながら分子を探す手続きとは逆向きだ。ある性質を持つ分子を探索せずに設計できる」とシュナイダー氏はswissinfo.chに語った。
逆方向の創薬プロセスを既に実践的に活用しているスタートアップも存在する。香港拠点のインシリコ・メディシン(Insilico Medicine)は、創薬標的の探索・同定と薬物候補の創出を行う生成AIシステムを開発。深刻な肺疾患である肺線維症の治療薬開発に適用し、現在、第II相臨床試験まで進んでいる。ここまでに要した期間・コストは18カ月・約300万ドルと、従来方法よりもはるかに高速・低コストだ。インシリコ・メディシンは2022年、フランスの製薬大手サノフィと最大12億ドル相当の提携を結んだ。創薬標的の同定と薬物候補の提案を実施する。
ジェネンテック(ロシュの子会社)は、同社が開発した深層学習を用いたAIモデルGNEPropで「スーパーバグ(超多剤耐性菌)」(複数の抗生物質に耐性のある細菌)に効く複数の抗生物質(低分子)候補を見つけた。その分子のいくつかを実験室でテスト後、一部を非臨床試験に進めている。実験データはAIモデルにフィードバックし、予測の精度向上に利用する。
ロシュのオズキリムリ氏は「創薬にはある種の試行錯誤的な側面がある。その一部を機械学習モデルに組み込み、より正確な予測を行おうとしている」と説明する。
ヒトという複雑系との対峙
製薬企業は、AI技術に巨額の資金を投じ、新分子の発見に湧き立っている。だが依然として、それがAIの成果であると表明することには慎重だ。臨床試験中のどの分子がAIを使って見つけたものかは公表していない。コンピューターや実験室で良い結果が出ても、患者の体内でうまく働くとは限らない。
医薬品開発の成功率は極めて低く、従来の創薬プロセスで臨床試験の全フェーズを通過できる薬は1割ほどしかない。AI技術を利用した創薬プロセスの方が成功率が高いかどうかに関しては、現時点では何も言えない。また、もしAI創薬プロセスの方が優れているとしても、どのAIアルゴリズムが最も予測精度が高いかを議論するのは時期尚早だ。
ETHZのシュナイダー氏は「ヒトの生物学(ヒトの体内で起こっていること・仕組みなど)、病気の進化、患者によって薬の効き方が違う理由など、まだ解明されていないことが多く残されている。最近はAIツールの潜在的な利点が派手に宣伝されがちだが、それは、ヒトという生物の混沌とした世界を見落としているからだ」とswissinfo.chに語った。
4月に公開された論文外部リンクによれば、過去10年間でAIファーストのバイオテックと製薬企業の連携で開発され、臨床試験まで進んだ分子(以下、AI創薬分子)は75種類だ。これらの第I相臨床試験の成功率は8〜9割で、従来平均(5〜6割)よりもかなり高い。
だが、その翌月に科学雑誌サイエンスに掲載された同論文に対する論説記事外部リンクは、これらの薬の設計におけるAI利用の範囲や程度に大きなばらつきがあるため「AIの成功」と一般化して論ずることは難しいと指摘する。AI創薬分子の成功率の根拠となっているサンプル数が極めて少ないことも問題であるとし、根本的な研究方法を批判した。さらに、薬がヒトに効くかどうかが初めて調べられる第II相臨床試験での成功率は従来平均と全く同じであり、AI創薬が優位であるという同論文の主張に疑問を投げかけた。
既にお蔵入りになったAI創薬分子もある。スタートアップ企業エクセンシア(Exscientia)は昨年10月、新規がん免疫療法バイオマーカーEXS-21546の臨床試験を初期フェーズで断念したと発表した。その数カ月前には、英国ロンドン拠点のベネボレントAI(BenevolentAI)が開発したAI創薬分子の有効性が、予想よりも低いことが臨床試験の初期フェーズで判明した。
エンドジェナのシュテーガー氏は、臨床試験でうまくいかない要因についてこう語る。「大部分の薬物候補が失敗する原因は、分子そのものにあるわけではない。大抵の場合、分子は想定通りに働いているが、個々の患者の病態と分子生物学の理屈がうまくかみ合わず、仮説通りにいかないケースがあるからだ」
編集:Virginie Mangin/ds、 英語からの翻訳、情報提供:佐藤寛子、校正:大野瑠衣子

JTI基準に準拠




















swissinfo.chの記者との意見交換は、こちらからアクセスしてください。
他のトピックを議論したい、あるいは記事の誤記に関しては、japanese@swissinfo.ch までご連絡ください。