Ayuda equina en test de detección de COVID-19

Cuando la COVID-19 frenó los planes de una firma suiza para diagnosticar enfermedades respiratorias en caballos, la empresa emergente decidió revertir la situación y utilizar su tecnología para la detección de este virus en humanos.
Si usted jamás ha escuchado sobre el llamado diagnóstico de Ender es totalmente normal. En abril pasado no existía.
A principios del 2020, la empresa emergente suiza LiVET estaba a punto de incrementar el número de pruebas de campo de su examen isotérmico diseñado para diagnosticar cuatro de las enfermedades respiratorias más comunes en los caballos, pero llegó el confinamiento provocado por el coronavirus. Se postergaron todos los viajes previstos y algunas máquinas LiVET previstas para realizar pruebas en caballos fueron necesarias para identificar la COVID-19.
Gracias al talento de brillantes científicos, el director general de LiVET, Tim Pfister, se planteó la posibilidad de que su compañía empleara parte de sus conocimientos y recursos en el desarrollo de una prueba rápida de COVID-19 para humanos.
«No sabíamos cuánto durarían el cierre de actividades y el confinamiento, así que nos preguntamos si podíamos utilizar lo que sabíamos sobre el diagnóstico de enfermedades respiratorias en caballos para desarrollar una prueba de detección de la COVID-19 (para humanos)”, dice Pfister a swissinfo.ch.
Así, en unas cuantas semanas, el equipo de Pfister duplicó su tamaño y apoyado en el grupo de inversores que ya tenía y en fondos privados adicionales, se fundó una nueva empresa: ender diagnostics. A dos meses de su nacimiento, la firma consiguió la certificación europea (conocida como marcado CE), que reconoce un riguroso cumplimiento de normas de seguridad y rendimiento homologadas en la UE para su prueba rápida de diagnóstico de COVID-19Enlace externo llamada ender LAB.
La marca CE le permite comenzar a vender su prueba a laboratorios y hospitales de Suiza y Europa.
Este mes de julio prevé lanzar una prueba todavía más rápida que ha llamado «prueba de ender móvil» que combina su tecnología con un dispositivo portátil que permitiría realizar pruebas en cualquier lugar, por ejemplo, en los aeropuertos. El avance sería significativo porque evita la necesidad de desplazar los grandes equipos que hay en laboratorios y hospitales para realizar estos exámenes. Según su modelo, el dispositivo móvil es capaz de procesar 8 o 16 muestras simultáneamente.
Y ender no es el único emprendedor que se lanza al ruedo. Tras la experiencia vivida de la escasez de pruebas de diagnóstico de COVID-19 al inicio de la pandemia, se ha observado una importante expansión en el número de fabricantes que desarrollan pruebas para la identificación de contagios de coronavirus. Algunas, como ender, son empresas emergentes que tuvieron que dejar de lado sus planes originales para atender el desafío impuesto por la COVID-19, ya que poseían la experiencia científica y estructuras ágiles propicias para aprovechar estas nuevas oportunidades de negocio.
Obstáculos reglamentarios
Una flexibilización de los requisitos obligatorios para la producción de pruebas de diagnóstico de la COVID-19 jugó a favor de empresas como ender. Reconociendo la necesidad de disponer de pruebas lo más rápido posible, las autoridades de la Unión Europea (UE) y de Estados Unidos aligeraron los requisitos para permitir que más fabricantes pudieran ofrecer pruebas de diagnóstico en el mercado.
Una nueva y más estricta directiva que debían cumplir las empresas productoras de dispositivos médicos entraría en vigor el 26 de mayo pasado, pero la Comisión Europea acordó a principios de abril posponerla hasta el 2021 por la pandemia. Así, sigue en vigor la antigua directivaEnlace externo (98/79 / CE) para dispositivos médicos de diagnóstico in vitro, que convierte a fabricantes como ender en los responsables de garantizar el cumplimiento de estándares sin que medie la verificación de terceros.
La Agencia Suiza para Productos Terapéuticos, Swissmedic, confirmó a swissinfo.ch que ha recibido la documentación de la compañía, pero advierte que tener el marcado CE no es sinónimo de tener una autorización específica para sus pruebas de detección, así que, en efecto, la responsabilidad total sobre la efectividad de estos exámenes recae integralmente en la compañía.
Esencialmente, hay dos tipos de pruebas para detectar la COVID-19.
El primero consiste en diagnosticar el contagio a través de una prueba molecular que utiliza la reacción en cadena de la polimerasa de transcripción inversa (RT-PCR) para identificar material genético del virus. Muchas empresas utilizan este método, entre ellas ender, y también la prueba de diagnóstico de Roche. Este tipo de exámenes es recomendado por la Organización Mundial de la Salud.
En el caso de ender, el método solamente varía ligeramente involucrando la tecnología isotérmica. Una tecnología similar a la PCR en la forma en que amplifica pequeñas cantidades de información genética (específicamente el ARN del virus SARS-CoV-2). Pero en vez de trabajar a varias temperaturas durante el proceso, como lo hace tradicionalmente la prueba PCER, la isotérmica realiza toda la detección a una sola temperatura, lo que le permite ganar tiempo.
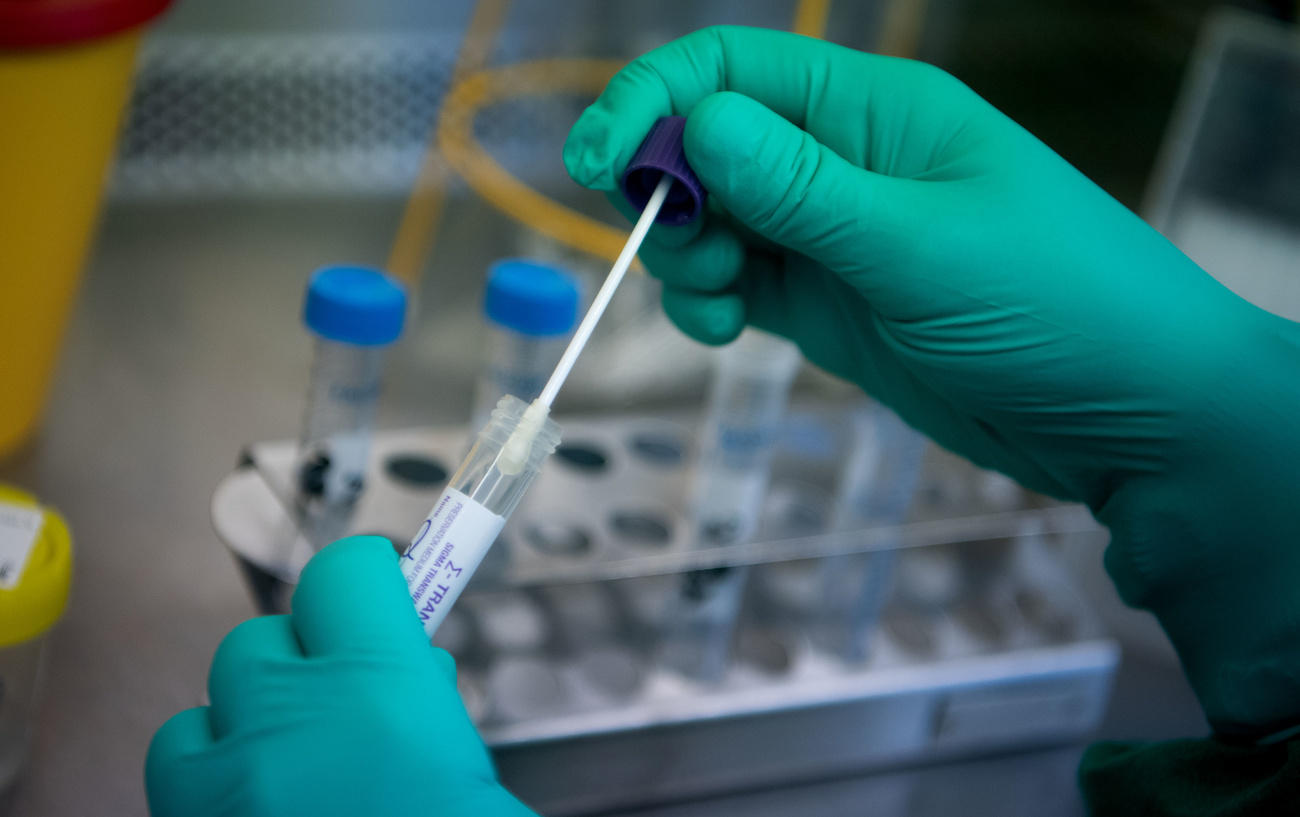
Los resultados de las pruebas ender LAB están disponibles en los 30 minutos posteriores a la extracción del ARN viral. Un lapso significativamente menor que el de las pruebas comerciales de PCR que están disponibles, dice Pfister. Por otra parte, la prueba ender tiene un índice de sensibilidad del 97,3% (porcentaje de precisión de los resultados positivos que arroja la prueba) y una especificidad del 100% (capacidad para identificar correctamente a aquellos sin la enfermedad), que en ambos casos son niveles de precisión muy elevados.
El segundo método de pruebas se basa en los antígenos que detectan componentes del virus como, por ejemplo, las proteínas. Todas las pruebas que detectan la infección actual de COVID-19 se realizan a partir de muestras de secreción de la nariz o garganta.
También hay pruebas serológicas de sangre disponibles que permiten identificar si se tuvo la enfermedad en el pasado, o si la persona en cuestión ha desarrollado anticuerpos contra el coronavirus
A principios de abril, la Unión Europea reportaba 78 pruebas PCER y 13 pruebas rápidas de antígenos que recibieron el marcado CE. DE acuerdo con la base de datos de la UEEnlace externo, en junio hay más de 100 pruebas PCER en el mercado. La Food and Drug Administration (FDA), autoridad sanitaria estadounidense, también ha concedido más de 100 Autorizaciones de Uso de Emergencia para pruebas de diagnóstico y de anticuerpos.
Las citadas aprobaciones regulatorias exprés no están exentas de riesgos y contratiempos. Por ejemplo, la FDA se vio obligada a revocar 40 pruebas de anticuerposEnlace externo (utilizadas para identificar contagios pasados). En su turno, la Federación Europea de Seguridad también identificó documentos falsosEnlace externo para pruebas y equipos de protección.
De regreso al ruedo
¿Cómo logró ender que una tecnología diseñada para equinos fuera empleada exitosamente en humanos? Pfister explica que trabajar con hisopos nasales, en vez de hacerlo con muestras de sangre, permite que sea relativamente fácil transferir el conocimiento.
«Lo que hemos hecho es dominar el conocimiento sobre la prueba de hisopo nasal. Esto nos ayudó a ser rápidos en el desarrollo de la prueba de COVID-19 y a lograr buenos resultados”. Otras compañías de diagnóstico veterinario, como AniCon, con sede en Alemania, también han usado su experiencia para el coronavirus humano.
A pesar de que ender está utilizando su tecnología en humanos, Pfister no planea renunciar en absoluto al trabajo con caballos y, potencialmente, con otros animales.
«El diagnóstico para los caballos es un nicho de mercado y un inicio perfecto para una empresa emergente en el mercado veterinario, ya que existen menos obstáculos regulatorios y el retorno de la inversión es atractivo”, dice.

En cumplimiento de los estándares JTI
Mostrar más: SWI swissinfo.ch, certificado por la JTI












Puede encontrar todos nuestros debates aquí y participar en las discusiones.
Si quiere iniciar una conversación sobre un tema planteado en este artículo o quiere informar de errores factuales, envíenos un correo electrónico a spanish@swissinfo.ch.