Nuevos fármacos contra el Alzheimer, entre la esperanza y el bombo

Se espera que el organismo que regula los medicamentos en Suiza, Swissmedic, para finales de año decida si aprueba, en dos décadas, el primer nuevo medicamento contra el Alzheimer. La decisión no será fácil.
La enfermedad de Alzheimer lleva décadas desconcertando a la investigación y las farmaceúticas han invertido miles de millones en esta dolencia que destruye, poco a poco, la memoria y la capacidad de pensar. Aunque hace 20 años, como mínimo, que no han presentado ningún medicamento nuevo.
Esto cambió en julio de 2023, cuando la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) para tratar el Alzheimer incipiente aprobó el lecanemab, comercializado bajo el nombre de Leqembi. Desde entonces también lo han aprobado las autoridades de Japón, China y Corea del Sur. El lecanemab es el primer fármaco que aborda tanto los síntomas de la pérdida de memoria como lo que se cree que es una causa subyacente de la enfermedad.
“El año pasado se dio un gran paso en la investigación del Alzheimer. Hacía tanto tiempo que no salían al mercado nuevos fármacos que la gente dejó de creer que incluso fuera posible tratar la enfermedad”, afirma Andrea Pfeifer, fundador y director general de AC Immune, una empresa biotecnológica de Lausana que lleva más de 20 años trabajando en terapias contra este trastorno.
Aunque la euforia no duró mucho en Europa. En julio de 2024, el comité de revisión de la Agencia Europea del Medicamento recomendó rechazar el fármaco. Citando preocupaciones de seguridad —como la inflamación y el sangrado en el cerebro—, argumentaron que hay más riesgos que beneficios.
Un mes después, la agencia reguladora británica autorizó el lecanemab, pero el Instituto Nacional para la Excelencia Sanitaria y Asistencial, que evalúa la rentabilidad de los fármacos, no lo incluyó para su reembolso. ¿Por qué? Porque el precio —26.500 dólares (22.300 francos suizos) al año en EE. UU. (y confidencial en el Reino Unido)— era excesivamente caro en relación con sus beneficios.

Mostrar más
El desarrollo de fármacos debe tener en cuenta el sexo y el género
Ahora, en Suiza, quienes padecen Alzheimer esperan con impaciencia qué va a decidir la autoridad reguladora Swissmedic, probablemente a finales de 2024. La decisión, ante tantas opiniones divergentes, no es sencilla. El regulador tiene que sopesar los beneficios y los riesgos de un medicamento para una enfermedad potencialmente mortal que todavía no se conoce del todo y que no ha experimentado ningún avance en décadas.
La decisión no solo va a afectar a las miles de personas con riesgo de padecer Alzheimer en Suiza o que viven con esta enfermedad, sino que también va a enviar una señal a los fabricantes de medicamentos sobre cuánto invertir en nuevos tratamientos para esta enfermedad.
El Alzheimer es la principal causa de demencia en el mundo. La demencia es un término general que hace referencia a una serie de síntomas que afectan a las capacidades cognitivas; la enfermedad de Alzheimer, por su parte, es un tipo específico de demencia que se caracteriza por la pérdida progresiva de memoria y el deterioro cognitivo.
Más de 55 millones de personas sufren demencia en el mundo y de ellas hasta el 70 % padece Alzheimer. En Suiza, hay unas 156.900 personas con Alzheimer u otra forma de demencia y, según la organización Alzheimer Suisse, se espera que la cifra en 2050 aumente a 315.400.
La enfermedad destruye lentamente la memoria y la capacidad de pensar y —con el tiempo— la capacidad de realizar tareas sencillas. La Organización Mundial de la Salud calcula que la enfermedad cuesta a los sistemas sanitarios alrededor de 1,3 billones de dólares cada año.
Muchas incógnitas
Una muestra de lo difícil que es avanzar en la enfermedad son las opiniones divergentes en torno al lecanemab. No hay pruebas concluyentes sobre cuál es la causa real del mal. Sigue sin haber un análisis de sangre aprobado para detectar si una persona tiene Alzheimer y cuánto ha avanzado la enfermedad.
Hasta la fecha, los fármacos solo han conseguido aliviar algunos síntomas, como la pérdida de memoria. Pero detectar la enfermedad en ese momento es demasiado tarde, porque la pérdida de memoria no puede revertirse.
“Hay que tratar la enfermedad pronto, es decir, antes de que el cerebro sufra daños”, explica Pfeifer, quien añade que para ello “hay que averiguar si una persona tiene riesgo de desarrollar Alzheimer 15 o 20 años antes de que empiecen los síntomas”.
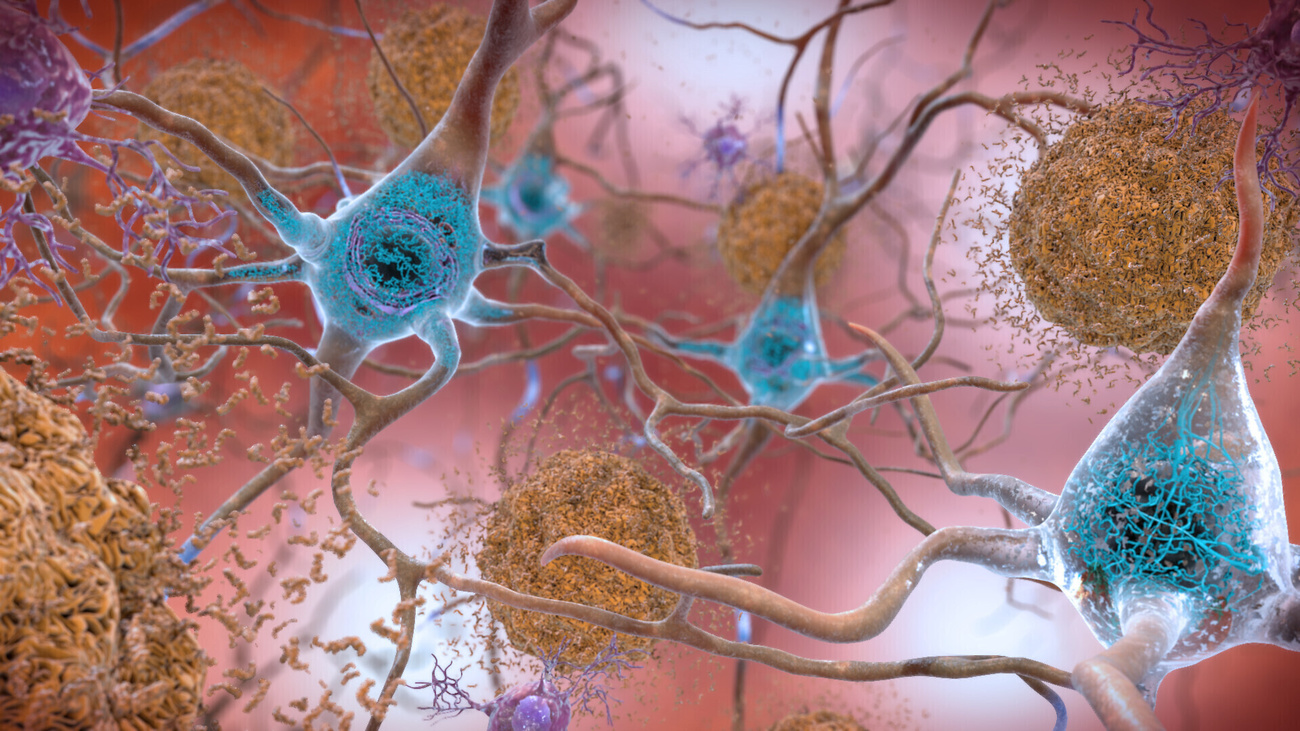
Esto ha llevado a las farmacéuticas a centrarse en qué ocurre en el cerebro de quienes padecen Alzheimer. Los escáneres cerebrales muestran niveles inusuales de proteína beta amiloide, que se acumula en el cerebro formando placas que alteran la función celular. El lecanemab forma parte de un nuevo grupo de medicamentos dirigidos contra estas placas.
Mostrar más
Suiza produce un medicamento innovador contra el Alzheimer
Pero para saber si los fármacos evitan la pérdida de memoria no basta con medir la cantidad de placas en el cerebro. Algunas personas que tienen placas nunca llegan a desarrollar demencia. Ciertas medicinas redujeron las placas, pero no produjeron cambios en la pérdida de memoria o la cognición.
El primer fármaco que no solo redujo las placas cerebrales, sino también la progresión de los síntomas, fue el lecanemab, comercializado por la empresa estadounidense Biogen y la japonesa Eisai. El principal ensayoEnlace externo con más de 1.700 personas con Alzheimer en fase inicial demostró que el medicamento ralentizaba el deterioro cognitivo en un 27 % en comparación con un placebo en 18 meses.
Aunque fue un momento decisivo para quienes se dedican a investigar la enfermedad, a los reguladores les ha resultado difícil interpretar qué significa esto para las personas que la sufren. Hay expertos que dicen que podría mantener a raya la demencia durante apenas cinco meses; otros, por su parte, señalan que los modestos efectos podrían, incluso, no ser perceptibles para la persona enferma o quien la trata.
“En una fase temprana de la enfermedad, el principio activo reduce los depósitos de proteínas nocivas en el cerebro y retrasa así la progresión de la enfermedad. El lecanemab, sin embargo, no puede curar ni detener la enfermedad de Alzheimer”, responde por correo electrónico la portavoz de la asociación Alzheimer Suisse, Jacqueline Wettstein.
Este beneficio también debe sopesarse frente a los efectos secundarios, entre ellos la inflamación cerebral o las microhemorragias que, conforme el ensayo, pueden provocar pequeños dolores de cabeza y, en algunos casos, la muerte.
Cuando la FDA aprobó el lecanemab dijo que el fármaco era seguro y mostraba un beneficio clínicamente significativo. La Agencia Europea del Medicamento, por su parte, llegó a una conclusión diferente: “los beneficios del tratamiento no son lo suficientemente grandes como para compensar los riesgos asociados a Leqembi (lecanemab)”.
Incluso cuando los organismos reguladores han aprobado el fármaco, algunas aseguradoras sanitarias se han negado a pagarlo —como en el Reino Unido—, con el argumento de que, para los pocos beneficios que aporta, es demasiado caro. El precio del fármaco en Estados Unidos es de 26.500 dólares al año, sin incluir los costes de las inyecciones quincenales y el seguimiento.
Avances gratificantes
Para Antonella Santuccione Chadha, neurocientífica que trabajó en el desarrollo de fármacos contra el Alzheimer y ahora dirige la Women’s Brain Foundation, con sede en Zúrich, la ecuación beneficio-riesgo debe considerarse en el contexto más amplio de la investigación sobre el Alzheimer.
“Entiendo que los riesgos asociados a estos fármacos son elevados en relación con los beneficios, pero puede que este sea el precio que tengamos que pagar para avanzar en la investigación de esta devastadora enfermedad que no tiene cura”, reconoce Santuccione Chadha.
En la última década, más de 200 programas de investigación se han abandonado o han fracasado en las últimas fases de los ensayos clínicos, cuando los fármacos se prueban en un gran número de personas, tal y como asegura la empresa estadounidense de investigación sanitaria IQVIAEnlace externo.
IQVIA estima que el coste total de desarrollar un tratamiento contra el Alzheimer es de unos 5.600 millones de dólares, frente a los 793,6 millones de un medicamento contra el cáncer.
Tal y como señala Pfeifer, que en Estados Unidos se aprobara el lecanemab envió a empresas como la suya el mensaje de que merece la pena invertir. Se calcula que en 2024 el fármaco generaráEnlace externo en el mundo 361 millones de dólares.
“Puede que estos nuevos fármacos no sean curas perfectas, pero en muchas personas están ralentizando el deterioro cognitivo. Si no se aprueban fármacos que al menos sean algo eficaces, ¿quién invertirá en investigar el Alzheimer para sacar al mercado la próxima generación de medicamentos?, se pregunta Pfeifer.
Un año después de aprobarse el lecanemab, la FDA dio luz verde a un segundo fármaco, el donanemab, que la empresa estadounidense Eli Lilly comercializa como Kisunla. Los organismos reguladores del Reino Unido, Europa y Australia todavía lo están valorando.
En la plataforma estadounidense clinicaltrials.gov hay registrados 160 ensayos clínicos que evalúan 127 fármacos contra el Alzheimer. En la actualidad se investigan pruebas de diagnóstico en sangre y nuevos fármacos contra la inflamación y otras proteínas, además de la beta amiloide, responsables de la enfermedad.
La empresa biotecnológica con sede en Lausana AC Immune lleva 20 años trabajando en pruebas diagnósticas e inmunoterapias que aprovechan la capacidad de las células inmunitarias para eliminar las placas del cerebro. AC Immune tiene cinco fármacos en fase de ensayo clínico e investiga nuevas causas subyacentes de la enfermedad.
“Cada estudio mejora nuestra comprensión de la enfermedad. Basándonos en estos éxitos, la próxima generación llegará aún más rápido y proporcionará mayores beneficios y una seguridad mejorada”, indica Pfeifer. En mayo de 2024, la empresa japonesa Takeda y AC Immune cerraron un acuerdo por un valor inicial de 100 millones de dólares y posibles miles de millones más adelante si la empresa tiene éxito. En virtud del acuerdo, Takeda tiene la opción exclusiva de otorgar los derechos mundiales de una de sus inmunoterapias en fase de ensayo clínico.
Es hora de una cura
No está claro cómo se va a pronunciar Swissmedic sobre el lecanemab. En mayo de 2023, Eisai presentó una solicitud para que Swissmedic autorizara el fármaco. Una persona en nombre de Swissmedic ha declarado a SWI que no puede compartir detalles sobre una decisión pendiente. No es raro que el regulador tarde más de un año en tomar una decisión.

Mostrar más
¿Cómo se determinan los precios de los medicamentos?
Como Suiza no forma parte de la Unión Europea, Swissmedic toma sus decisiones con independencia de la Agencia Europea del Medicamento; asimismo, trabaja con especialistas para comprobar que el producto “cumple los requisitos de eficacia, calidad y seguridad”.
El año pasado Swissmedic autorizó alrededor del 84 % de las solicitudes de nuevos fármacos (41 nuevos medicamentos). En ese mismo periodo, la FDAEnlace externo estadounidense aprobó la misma proporción, el 84 % (55 nuevos fármacos).
Incluso si el lecanemab ofrece un beneficio mínimo, quienes padecen Alzheimer esperan una decisión positiva en Suiza. Y es que la gente ahora solo puede importar el fármaco abonando su coste.
Tras años de investigación, tenemos por fin en la recta final un fármaco que —según Wettstein— al menos puede retrasar la enfermedad en una fase temprana. El lecanemab no puede detener la enfermedad de Alzheimer. “Pero si se administra en una fase temprana de la enfermedad, puede dar más tiempo a las personas que la padecen”, explica la portavoz de Alzheimer Suisse.
Editado por Virginie Mangin; adaptado del inglés por Lupe Calvo / Carla Wolff

En cumplimiento de los estándares JTI
Mostrar más: SWI swissinfo.ch, certificado por la JTI








Puede encontrar todos nuestros debates aquí y participar en las discusiones.
Si quiere iniciar una conversación sobre un tema planteado en este artículo o quiere informar de errores factuales, envíenos un correo electrónico a spanish@swissinfo.ch.